-
Fizyka
-
- Podstawowe wielkości, podstawowe jednostki
- Podstawowe zasady ochrony radiologicznej
- Ochrona radiologiczna - zwiększanie odległości
- Ochrona radiologiczna - osłony
- Ochrona radiologiczna - czas
- Oddziaływanie promieniowania alfa z materią
- Oddziaływanie promieniowania beta z materią
- Oddziaływanie promieniowania gamma z materią
- Ochrona przed promieniowaniem neutronowym
- Dawki graniczne
- Licencjonowanie i nadzór działalności związanej z narażeniem na promieniowanie jonizujące
-
Technologia
-
- Co to jest elektrownia?
- Generacje elektrowni jądrowych
- Rodzaje reaktorów dla elektrowni jądrowych (klasyfikacja)
- Reaktor wodny ciśnieniowy (PWR)
- Reaktor wodny wrzący (BWR)
- Reaktor ciężkowodny ciśnieniowy (PHWR) - CANDU
- Reaktor lekkowodny moderowany grafitem (LWGR) - RBMK
- Reaktor chłodzony gazem (GCR, AGR, MAGNOX)
- Reaktor wysokotemperaturowy (HTR)
- Reaktor prędki powielający (FBR)
- Małe reaktory modułowe (SMR)
- Teren elektrowni jądrowej
- Reaktory jądrowe na okrętach podwodnych i statkach
-
- Bezpieczeństwo jądrowe - jak to się zaczęło?
- Czym jest bezpieczeństwo jądrowe?
- Bardzo ważne zadanie - ochrona przed promieniowaniem
- Incydent a awaria
- Zasady zapobiegania awariom
- Filozofia systemów bezpieczeństwa
- Co robić, jeśli mimo wszystko awaria się wydarzy?
- Generacje reaktorów a bezpieczeństwo
- Elektrownia jądrowa nie może wybuchnąć jak bomba atomowa!
- Oddziaływanie elektrowni jądrowych na środowisko: rodzaje emisji i monitorowanie środowiska
- Woda z elektrowni jądrowej jest bezpieczna!
- Ocena bezpieczeństwa, ocena ryzyka
- Dozór jądrowy w Polsce
-
- Skąd się biorą odpady promieniotwórcze?
- Rodzaje odpadów promieniotwórczych
- Co robimy z odpadami promieniotwórczymi w Polsce?
- Przetwarzanie odpadów promieniotwórczych
- Składowanie odpadów nisko- i średnioaktywnych
- Ile odpadów promieniotwórczych wytwarza elektrownia jądrowa?
- Jak transportujemy odpady promieniotwórcze?
- Postępowanie z wypalonym paliwem jądrowym
- Co się dzieje z wypalonym paliwem jądrowym po wyjęciu z rdzenia reaktora?
- Recykling wypalonego paliwa jądrowego - zamknięty cykl paliwowy
-
Społeczeństwo
-
- Percepcja społeczna - odkrycie promieniowania jonizującego
- Percepcja społeczna - era rozszczepienia i wykorzystanie energii jądrowej
- Percepcja społeczna - awaria w elektrowni Three Mile Island i w Czarnobylu
- Percepcja społeczna - model oceny skutków biologicznych promieniowania jonizującego
- Energetyka jądrowa - najbardziej bezpieczną metodą pozyskiwania energii
- Główne obawy dotyczące bezpieczeństwa elektrowni jądrowych
- Poparcie dla energetyki jądrowej w Polsce
-
- [MIT] Ludzie mieszkający w pobliżu elektrowni jądrowej otrzymują zwiększone dawki promieniowania jonizującego
- [MIT] Świat odchodzi od energetyki jądrowej
- [MIT] Polska nie poradzi sobie z budową i eksploatacją elektrowni jądrowej
- [MIT] Elektrownia jądrowa jest łatwym celem dla terrorystów
- [MIT] Energetyka jądrowa nie jest bezpieczna
- [MIT] Odpady promieniotwórcze nie mogą być bezpiecznie transportowane
- [MIT] System chłodzenia elektrowni bardzo szkodzi środowisku wodnemu i populacji ryb
- [MIT] Stopienie rdzenia reaktora jest bardzo prawdopodobne
- [MIT] Zużyte paliwo jest silnie radioaktywne i trzeba je chronić nawet przez 10 000 lat
Układ okresowy pierwiastków
Atomy nie są identyczne: różnią się liczbą protonów i neutronów w jądrze, jak również liczbą elektronów w powłoce.
Porządkuje się zatem atomy w „układzie okresowym” według rosnącej liczby protonów (liczby atomowej). Wodór ma tylko jeden proton, zajmuje więc pierwsze miejsce na górze po lewej stronie. W neonie (drugi rząd, całkiem po prawej stronie) znajduje się natomiast już dziesięć protonów, a więc jego liczba atomowa to 10. Ostatnim pierwiastkiem naturalnym jest uran. W jego jądrze znajdują się 92 protony.
Klasyfikacja na podstawie własności chemicznych
Dla chemii jądro atomowe ma jedynie znaczenie drugorzędne: to ładunek elektryczny jądra wyznacza liczbę i strukturę powłok elektronowych. Ponieważ liczbie protonów musi odpowiadać liczba elektronów w powłoce, w rezultacie atom jako całość jest elektrycznie obojętny. Pierwiastki o zbliżonych własnościach chemicznych znajdują się w układzie okresowym w kolumnach pionowych. Pierwiastki posiadające własności chemiczne podobne do neonu, takie jak hel, argon, krypton i ksenon są „zatwardziałymi singlami”. Jako gazy szlachetne nie tworzą związków chemicznych.
Układ okresowy
W układzie okresowym pierwiastki ułożone są rzędami i uporządkowane według rosnącej liczby protonów. Wszystkie pierwiastki o liczbie atomowej 93 i wyższej są pierwiastkami wytworzonymi sztucznie. Niektóre pierwiastki takie jak: technet, promet, astat, neptun i pluton były najpierw wytworzone sztucznie. Później dowiedziono, że występują w ilościach śladowych również naturalnie w przyrodzie.
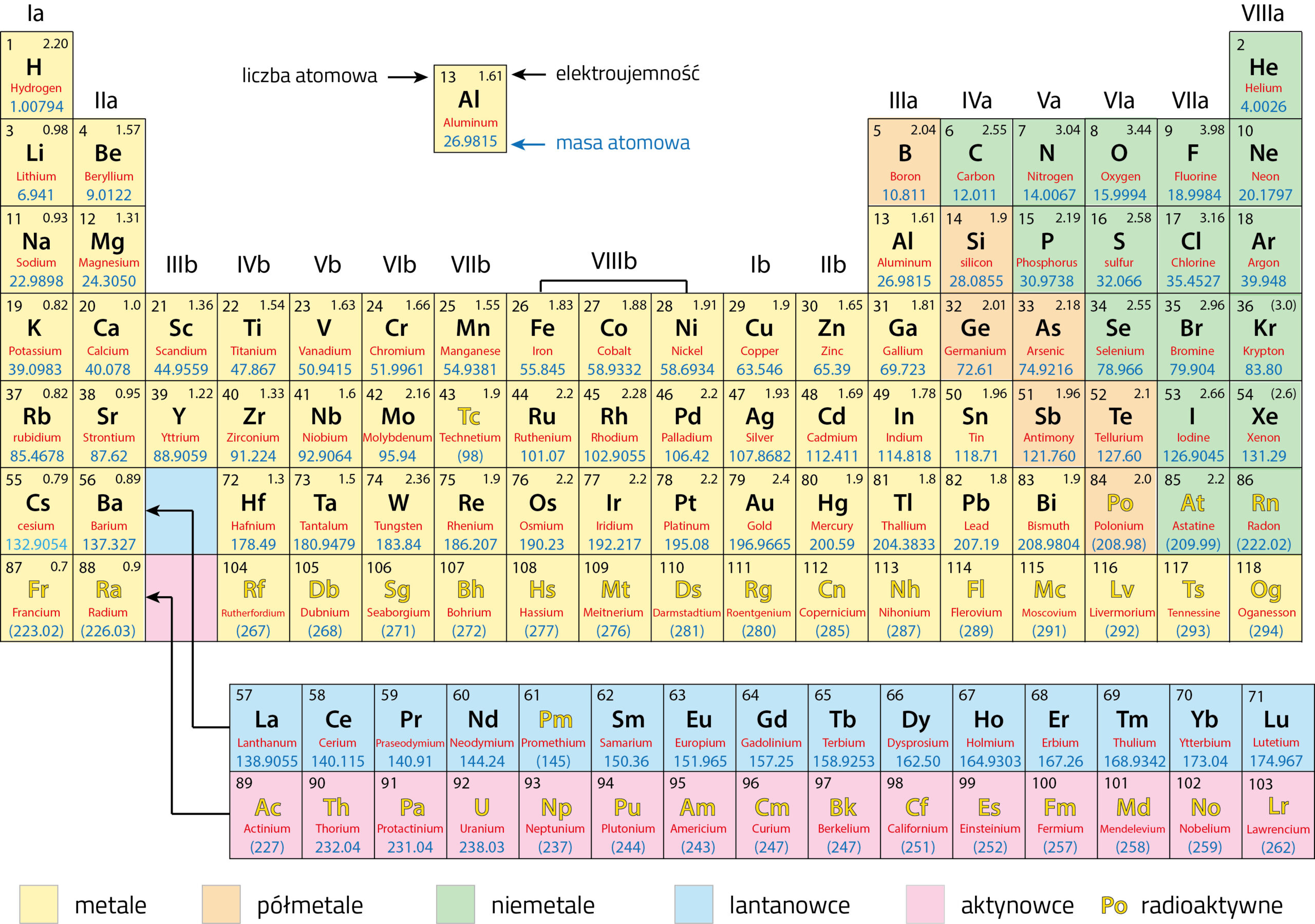
Zapamiętaj!
Wszystkie pierwiastki o liczbie atomowej 93 i wyższej nie występują naturalnie na Ziemi. Wytwarza się je sztucznie w laboratoriach z wykorzystaniem akceleratorów i reaktorów jądrowych.
- uran
- pierwiastki
- układ okresowy
- układ okresowy pierwiastków
- pierwiastek
- radon
- rozpad promieniotwórczy
- jądro atomowe
- energia
- fizyka jądrowa
- elektrownia konwencjonalna
- elektrownia
- reakcja łańcuchowa
- medycyna nuklearna
- ochrona radiologiczna
- pluton
- rozszczepienie
- reaktor atomowy
- reaktor jądrowy
- promieniowanie jonizujące
- energetyka jądrowa
- elektrownia atomowa w Polsce
- elektrownia jądrowa w Polsce
- elektrownia atomowa
- elektrownia jądrowa
- reaktor badawczy
- promieniowanie
- atom
- energia atomowa
- energia jądrowa
- reaktor