-
Fizyka
-
- Podstawowe wielkości, podstawowe jednostki
- Podstawowe zasady ochrony radiologicznej
- Ochrona radiologiczna - zwiększanie odległości
- Ochrona radiologiczna - osłony
- Ochrona radiologiczna - czas
- Oddziaływanie promieniowania alfa z materią
- Oddziaływanie promieniowania beta z materią
- Oddziaływanie promieniowania gamma z materią
- Ochrona przed promieniowaniem neutronowym
- Dawki graniczne
- Licencjonowanie i nadzór działalności związanej z narażeniem na promieniowanie jonizujące
-
Technologia
-
- Co to jest elektrownia?
- Generacje elektrowni jądrowych
- Rodzaje reaktorów dla elektrowni jądrowych (klasyfikacja)
- Reaktor wodny ciśnieniowy (PWR)
- Reaktor wodny wrzący (BWR)
- Reaktor ciężkowodny ciśnieniowy (PHWR) - CANDU
- Reaktor lekkowodny moderowany grafitem (LWGR) - RBMK
- Reaktor chłodzony gazem (GCR, AGR, MAGNOX)
- Reaktor wysokotemperaturowy (HTR)
- Reaktor prędki powielający (FBR)
- Małe reaktory modułowe (SMR)
- Teren elektrowni jądrowej
- Reaktory jądrowe na okrętach podwodnych i statkach
-
- Bezpieczeństwo jądrowe - jak to się zaczęło?
- Czym jest bezpieczeństwo jądrowe?
- Bardzo ważne zadanie - ochrona przed promieniowaniem
- Incydent a awaria
- Zasady zapobiegania awariom
- Filozofia systemów bezpieczeństwa
- Co robić, jeśli mimo wszystko awaria się wydarzy?
- Generacje reaktorów a bezpieczeństwo
- Elektrownia jądrowa nie może wybuchnąć jak bomba atomowa!
- Oddziaływanie elektrowni jądrowych na środowisko: rodzaje emisji i monitorowanie środowiska
- Woda z elektrowni jądrowej jest bezpieczna!
- Ocena bezpieczeństwa, ocena ryzyka
- Dozór jądrowy w Polsce
-
- Skąd się biorą odpady promieniotwórcze?
- Rodzaje odpadów promieniotwórczych
- Co robimy z odpadami promieniotwórczymi w Polsce?
- Przetwarzanie odpadów promieniotwórczych
- Składowanie odpadów nisko- i średnioaktywnych
- Ile odpadów promieniotwórczych wytwarza elektrownia jądrowa?
- Jak transportujemy odpady promieniotwórcze?
- Postępowanie z wypalonym paliwem jądrowym
- Co się dzieje z wypalonym paliwem jądrowym po wyjęciu z rdzenia reaktora?
- Recykling wypalonego paliwa jądrowego - zamknięty cykl paliwowy
-
Społeczeństwo
-
- Percepcja społeczna - odkrycie promieniowania jonizującego
- Percepcja społeczna - era rozszczepienia i wykorzystanie energii jądrowej
- Percepcja społeczna - awaria w elektrowni Three Mile Island i w Czarnobylu
- Percepcja społeczna - model oceny skutków biologicznych promieniowania jonizującego
- Energetyka jądrowa - najbardziej bezpieczną metodą pozyskiwania energii
- Główne obawy dotyczące bezpieczeństwa elektrowni jądrowych
- Poparcie dla energetyki jądrowej w Polsce
-
- [MIT] Ludzie mieszkający w pobliżu elektrowni jądrowej otrzymują zwiększone dawki promieniowania jonizującego
- [MIT] Świat odchodzi od energetyki jądrowej
- [MIT] Polska nie poradzi sobie z budową i eksploatacją elektrowni jądrowej
- [MIT] Elektrownia jądrowa jest łatwym celem dla terrorystów
- [MIT] Energetyka jądrowa nie jest bezpieczna
- [MIT] Odpady promieniotwórcze nie mogą być bezpiecznie transportowane
- [MIT] System chłodzenia elektrowni bardzo szkodzi środowisku wodnemu i populacji ryb
- [MIT] Stopienie rdzenia reaktora jest bardzo prawdopodobne
- [MIT] Zużyte paliwo jest silnie radioaktywne i trzeba je chronić nawet przez 10 000 lat
Izotopy
Atomy nie są identyczne: różnią się liczbą protonów i neutronów w jądrze, jak również liczbą elektronów w powłoce, która jest równa liczbie protonów.
Liczba protonów w jądrze decyduje, do jakiego pierwiastka dane jądro należy. Dlatego atomy porządkuje się według rosnącej liczby protonów, czyli tzw. liczby atomowej. Tak uszeregowane atomy tworzą układ okresowy pierwiastków. Wodór ma tylko jeden proton, zajmuje więc pierwsze miejsce na górze po lewej stronie układu okresowego. W neonie (drugi rząd, całkiem po prawej stronie) znajduje się natomiast już dziesięć protonów, a więc jego liczba atomowa to 10. Ostatnim pierwiastkiem naturalnie występującym na Ziemi jest uran. W jego jądrze znajdują się 92 protony.
Wszystkie atomy tego samego pierwiastka mają stałą liczbę protonów i elektronów, jednak ilość neutronów w jądrze może być różna. Atomy tego samego pierwiastka o różnej liczbie neutronów w jądrze nazywamy izotopami. Przyjrzyjmy się powyższemu rysunkowi. Jądro atomu helu (He) z dwoma protonami i jednym neutronem nazywamy helem-3 lub He-3. Liczba 3 mówi nam, jaka jest całkowita liczba nukleonów w jądrze – nazywamy ją liczbą masową. Z kolei atom z dwoma neutronami określamy jako He-4. Uran występuje w przyrodzie w odmianach, które zawierają 234, 235 lub 238 nukleonów. Wiemy już, że wszystkie jądra uranu zawierają 92 protony. Stąd trzy izotopy uranu mają odpowiednio 142, 143 i 146 neutronów w swoich jądrach atomowych. Oznaczamy je jako U-234, U-235 i U-238.
Obecnie znamy 118 pierwiastków i ponad 3000 izotopów. Tylko 254 izotopy, oznaczone na tablicy izotopów (rysunek poniżej) czarnymi punktami są stabilne. Pozostałe rozpadają się emitując promieniowanie jonizujące, o czym opowiemy w kolejnym rozdziale.
Wszystko to, czego nauczyliśmy się o helu czy uranie nie dotyczy tylko tych dwóch pierwiastków. Takie same prawa fizyki odnoszą się do żelaza, złota, azotu, tlenu, radu, węgla i wszystkich pozostałych pierwiastków.
Zapamiętaj!
„Wizytówka” jądra atomowego X:
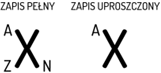
Z – liczba atomowa = liczba protonów w jądrze
N – liczba neutronów w jądrze
A – liczba masowa A = Z + N
Równoznaczny zapis: AX → X-A, np. 3He → He-3.
- rozpad promieniotwórczy
- ochrona radiologiczna
- medycyna nuklearna
- reakcja łańcuchowa
- elektrownia
- elektrownia konwencjonalna
- fizyka jądrowa
- energia
- jądro atomowe
- pluton
- radon
- nukleony
- izotopy
- izotop
- protony
- neutrony
- liczba atomowa
- liczba masowa
- elektrownia jądrowa w Polsce
- reaktor
- energia jądrowa
- energia atomowa
- atom
- promieniowanie
- reaktor badawczy
- elektrownia jądrowa
- elektrownia atomowa
- elektrownia atomowa w Polsce
- energetyka jądrowa
- promieniowanie jonizujące
- reaktor jądrowy
- reaktor atomowy
- rozszczepienie
- uran