Modele budowy atomów
Pomimo tego, że przyrodnicy od dawna badają świat atomów, jeszcze nikt nie zobaczył szczegółowo jak są zbudowane, są one po prostu zbyt małe. Tym niemniej kolejne eksperymenty pozwalają badaczom prezentować coraz dokładniejsze wyobrażenia na temat budowy atomów.
Od eksperymentu Rutherforda…
Pierwsze doświadczenie, które wykazało istnienie jądra atomowego przeprowadził Ernest Rutherford w 1911 r. „Eksperyment rozproszeniowy Rutherforda” pokazał, że atomy posiadają małe jądro o ładunku dodatnim, otoczone na zewnątrz ujemnie naładowaną powłoką. Ważnym krokiem naprzód było stworzenie modelu atomu przez Nielsa Bohra. Duński badacz założył, że elektrony poruszają się po orbitach wokół jądra atomowego – podobnie jak planety krążące po swych orbitach wokół Słońca.
…do efektów kwantowych
Eksperymenty pokazały jednak, że atomy mają często zaskakujące właściwości, nieznane w naszym codziennym świecie. Odkrycie tych właściwości – efektów kwantowych – doprowadziło w XX wieku do rozwoju nowego działu nauki – fizyki kwantowej, która dziś stanowi uznaną metodę pozwalającą zrozumieć, jak zbudowane są atomy. Od tego czasu elektrony nie są już przedstawiane jako mikroskopijne kuleczki na orbitach, a raczej jako cząstki zajmujące tzw. orbitale.
Porównanie modeli budowy atomów
Na początku 20. wieku Bohr i jego koledzy zakładali, że atomy wyglądają jak małe Układy Słoneczne (elektrony krążą wokół jądra jak planety wokół Słońca (rys. a), obecnie przedstawia się atomy przy pomocy orbitali (rys. b). Orbital jest określoną częścią przestrzeni wokół jądra atomu, w której istnieje duże prawdopodobieństwo napotkania elektronu; prawdopodobieństwo to można dokładnie obliczyć. Fizyka kwantowa pozwala również wyjaśnić takie fenomeny, jak łączenie się atomów w molekuły, czyli wiązania chemiczne.
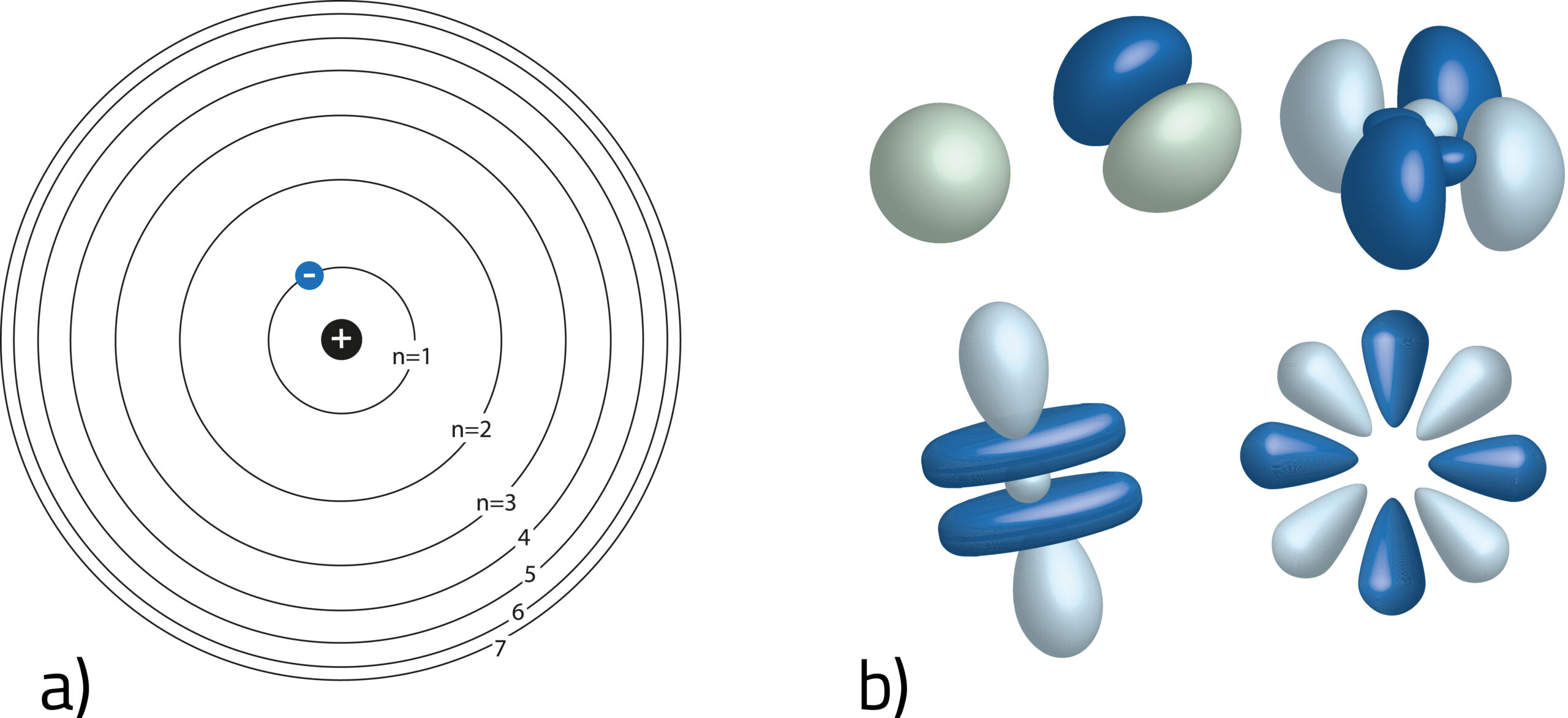
Elektrony na orbitach – model atomu Bohra
Ważną rolę w rozwoju nowoczesnej fizyki atomowej odegrał duński fizyk Niels Bohr. W jego modelu atomy wyglądają jak małe układy planetarne: elektrony poruszają się z dużą prędkością po orbitach kołowych wokół jądra atomu. Opierając się na tym założeniu Bohr objaśnił zjawisko serii linii widma atomu wodoru („linie Balmera”, nazwa pochodzi od nazwiska szwajcarskiego badacza Johana Balmera).
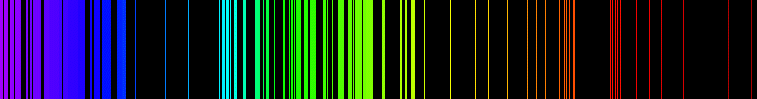
Linie widmowe. Jeżeli światło słoneczne, przechodzące przez wąska szczelinę, przepuścimy przez pryzmat, to na ekranie zobaczymy obraz szczeliny jako kolorową tęczę. To jest właśnie „widmo ciągłe światła białego” – energia emitowanego promieniowania zmienia się w sposób ciągły. Jeżeli szczelina aparatury oświetlona jest przez świecący gaz, to na ekranie widać kilka jasnych obrazów szczeliny w postaci „prążków” o różnych barwach, czyli „widmo liniowe”. Każda linia odpowiada ściśle określonej długości fali, czyli energii wysyłanego promieniowania. Na poniższych rysunkach pokazano liniowe widmo emisyjne wodoru i żelaza.
W owym czasie nie potrafiono przekonywująco wytłumaczyć zjawiska osobliwych linii widocznych po rozszczepieniu światła. Bohr zasugerował więc, że elektrony okrążają jądro poruszając się po pewnych stabilnych orbitach. Każda orbita cechuje się określonym poziomem energetycznym. Przy przejściu z jednej orbity na drugą różnica poziomów energetycznych uwalnia się w postaci światła o określonej długości fali. Na podstawie swojego modelu mógł on w 1913 r. dokładnie obliczyć energie linii widmowych serii Balmera, co stanowiło bardzo przekonywujący dowód słuszności dla stworzonego przez niego modelu budowy atomu.

Czy zatem elektrony w atomie są mini planetami?
Początkowo model Bohra, który został w późniejszym czasie zmodyfikowany (dopuszczono poruszanie się elektronów po orbitach eliptycznych), cieszył się dużą popularnością – nie tylko dlatego, że dobrze wyjaśniał zjawisko linii widmowych wodoru, ale także dlatego, że był tak jasny i obrazowy. Orbity? Na początku XX wieku fizycy doskonale się na tym znali. Już od dawna potrafiono dokładnie obliczyć pozycje planet. Dlaczego elektrony w atomie nie miałyby się zachowywać całkiem podobnie?
Jednak, gdyby przyjrzeć się dokładniej, podobieństwo to nie sięga wcale aż tak daleko. Planety mogą okrążać Słońce po dowolnych orbitach eliptycznych. Natomiast Bohr założył, że elektrony krążą tylko po orbitach o ściśle określonych promieniach. Tylko w taki sposób mógł wytłumaczyć istnienie linii w widmie wodoru. Zgodnie z jego teorią elektrony mogą stabilnie poruszać się po tych szczególnych orbitach wokół jądra, nie promieniując przy tym energii.
Dlaczego to zrobił?
Bohr jako fizyk wiedział, że ładunki – a jak wiadomo elektrony są naładowane ujemnie – emitują promieniowanie, kiedy poruszają się ruchem przyspieszonym. Ponieważ elektrony krążące wokół jądra doznają przyspieszenia, to powinny tracić energię w sposób ciągły, co z kolei powinno powodować, że ostatecznie spadałyby na jądro. Orientacyjne obliczenia pokazują, że spadek nastąpiłby już w drobnym ułamku sekundy. Ponieważ jednak oczywiście do tego nie dochodzi, Bohr uznał, że elektrony poruszające się po orbitach nie promieniują energii, co było sprzeczne z ówcześnie uznawanymi zasadami elektrodynamiki. Problem Bohra polegał na tym, że nie potrafił za pomocą swojego modelu wyjaśnić tej niezgodności z ówczesną fizyką.
Dziś teoria Bohra na temat elektronów, które okrążają jądro poruszając się po orbitach, została zastąpiona przez orbitale fizyki kwantowej. Fizycy przestali posługiwać się pojęciem orbit w odniesieniu do elektronów.